Woda, chociaż to bardzo prosta cząsteczka, bo składa się z tylko z 3 atomów – jednego tlenu i dwóch wodorów – jest fundamentem życia na Ziemi, a prawdopodobnie w ogóle we Wszechświecie (o ile takie znajdziemy). Nie bez powodu, obserwując dalekie układy słoneczne, astronomowie szukają tych planet, które znajdują się w tzw. strefie zamieszkiwalnej (ang. habitable zone), czyli ekostrefie umożliwiającej m.in. wystąpienie wody w stanie ciekłym. Wróćmy jednak na Ziemię i przyjrzymy się wodzie od strony jej ważnych dla życia właściwości…
Woda jako cząsteczka chemiczna
Zaczynając rozważania na temat wody, zacznijmy od podania podstawowych właściwości związanych z jej budową. Jak wspomniano, cząsteczka wody składa się dwóch wodorów i tlenu, czyli po prostu H2O. Wydaje się to nieskomplikowane i na tyle proste jak się da. Prostota ta ma jednak swoje złożone konsekwencje. Atom tlenu połączony jest z oboma wodorami parą wiązań kowalencyjnych. Wiązania te mają charakter polarny, oznacza to że występuje w takim przypadku nierównomierne rozłożenie cząstkowych ładunków elektrycznych. Fachowo mówi się, że taka cząsteczka posiada niezerowy elektryczny moment dipolowy. W przypadku wody, ładunek ujemny jest przesunięty w stronę atomu tlenu, a dodatni jest zlokalizowany w pobliżu jąder wodoru. Budowa cząsteczki wody i rozkład ładunku elektrycznego został przedstawiony na poniższym rysunku:
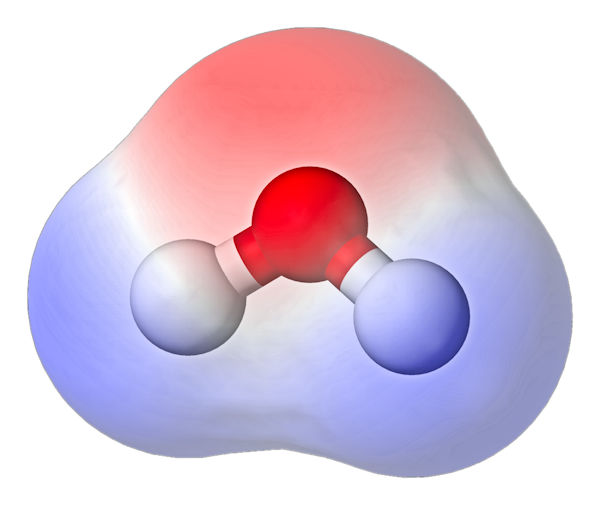
Cząsteczka wody (czerwona kulka – tlen, białe kulki – wodór) oraz rozkład ładunku elektrycznego (czerwony obłok – ładunek ujemny, niebieski – ładunek dodatni)
To właśnie polarność powoduje, że cząsteczki H2O łatwo tworzą wiązania wodorowe innymi cząsteczkami. W przypadku łączenia się ze sobą cząsteczek wody, jedna molekuła H2O może wytworzyć wiązanie wodorowe maksymalnie z 4 innymi cząsteczkami wody (co da się zaobserwować podczas tworzenia się lodu).
Ciekawostka
Kąt pomiędzy wiązaniami wodór-tlen-wodór to około 105°. Dotyczy to jednak fazy ciekłej, natomiast gdy woda zamarza zamieniając się w ciało stałe, kąt ten wzrasta do około 108°.
Woda jako rozpuszczalnik
Polarny charakter wody objawia się również w tym, że można w niej rozpuścić wiele substancji. Sytuacja ta ma miejsce, gdy wiązania wodorowe wytwarzane przez H2O zastępują słabsze wiązania w innych związkach chemicznych. Dzięki temu w wodnym roztworze może znaleźć się wiele substancji niezbędnych do biochemii komórki. Nie bez powodu taka cytoplazma to właśnie w większości woda. Tutaj warto wspomnieć o lipidach, które posiadają część niepolarną, nie rozpuszczającą się wodzie (hydrofobową), przez co mogą tworzyć zamknięte błony odgradzając obszary z wodą od otoczenia.
Napięcie powierzchniowe
Kolejną istotną właściwością wody jest jej napięcie powierzchniowe. Jest to wielkość fizyczna, mówiąca o energii przypadającej na jednostkę powierzchni wody, wynikającej z występowania sił przyciągania pomiędzy cząsteczkami tejże cieczy. W skrócie jest to miara siły jaką trzeba przyłożyć, aby zwiększyć powierzchnię cieczy o zadaną wartość, czyli rozsunąć cząsteczki działając przeciwnie do sił, którymi się przyciągają. Dla wody o temperaturze 18 °C jest to około 72,4 · 10−3 N/m.
To właśnie zjawiska związane z napięciem powierzchniowym odpowiadają za kształt kropel i umożliwiają utrzymywanie się pewnych materiałów na powierzchni wody, ponieważ zachowuje się ona jak sprężysta błona. Znów za te siły przyciągania pomiędzy cząsteczkami odpowiedzialne są wiązania wodorowe, które do najsłabszych nie należą. Jedną z ważnych konsekwencji tego zjawiska jest fakt, że woda znajdująca się w cienkiej kapilarze może przemieszczać się „ku górze”, a precyzyjniej wbrew przyciąganiu grawitacyjnemu. Zjawisko kapilarne umożliwia też zachowanie ciągłości słupa wody, co jest kluczowe dla transportu tej cieczy np. u roślin, czego przykładem są drzewa sięgające ponad 100 metrów (rekord należy do sekwoi wieczniezielonej o nazwie Hyperion mierzącej aż 115,61 metrów!)
Woda jako magazyn ciepła
Właściwości cieplne wody, czyli to w jaki sposób może magazynować i przekazywać ciepło to kolejne ważne dla organizmów parametry. Ciepło, to jakby nie patrzeć jedna z form przekazywania energii, a bez energii nie ma życia. Woda, ma z kolei to do siebie że z jednej strony potrzeba włożyć sporo energii (ciepło właściwe: 4187 J/kg·K), aby podnieść temperaturę o kolejne stopnie (zwiększyć średnią energię kinetyczną cząsteczek), a także aby „odłączyć” od siebie cząsteczki, zrywając wiązania wodorowe miedzy molekułami H2O (ciepło parowania: 2257 kJ/kg). Ma to ogromne znaczenie dla organizmów żywych w procesach termoregulacji – w przypadku roślin, parująca woda na powierzchni liścia chroni przed nadmiernych pochłanianiem energii promieni słonecznych, a w przypadku zwierząt tego typy funkcję pełni proces pocenia się.
Gęstość wody
Woda zwiększa swoją objętość podczas zamarzania, co jest może dość nieintuicyjnym zjawiskiem. Wszystko przez formowanie się, wraz ze spadkiem temperatury, sieci krystalicznej, w której pomiędzy ustawionymi „na stałe” cząstkami wody znajduje się dużo wolnego miejsca. Doprowadza to do sytuacji, w której lód ma mniejszą gęstość niż woda w stanie ciekłym, dzięki czemu może unosić się na jej powierzchni. Powoduje to, że zbiorniki wodne zamarzają „od góry”, a nie od dna, przez co organizmy wodne mogą przeżyć pod lodem, który jest wypychany na powierzchnię zbiornika.
Największą gęstość (ok. 999,973 kg/m3) woda osiąga w temperaturze 4 °C. W temperaturze 0 °C, gęstość wody wynosi około 999,841 kg/m3 , a dla temperatury 25 °C, gęstość osiągnie wartość ok. 997,044 kg/m3.