Jedną z wielu technik spektroskopowych w badaniach biofizycznych i nie tylko jest spektroskopia absorpcyjna. Zasadą działania tej techniki jest zjawisko pochłaniania fali elektromagnetycznej przez materię (absorpcja). Energia pochodząca ze światła zostaje zamieniona na inne postaci energii takie jak ciepło lub energia potrzebna do przeniesienia elektronu na wyższe powłoki elektronu (stany wzbudzone). Spektroskopia absorpcyjna wykorzystywana jest w zakresie widzialnym i ultrafiolecie, stąd też inna nazwa – spektroskopia UV-VIS (UltraViolet-VISible). Spektrometry które stosowane są do tego typu badań, przeważnie pracują w zakresie fal od 200 do 800 nm.
Ze zjawiskiem absorpcji światła spotykamy się codziennie. Gdy światło białe przechodząc przez substancję zostaje w części zaabsorbowane, do oczu obserwatora dociera tzw. „barwa dopełniająca”. Jest to fala elektromagnetyczna składająca się ze wszystkich rodzajów fal, które nie zostały pochłonięte przez ośrodek. Dzięki temu jesteśmy w stanie rozróżniać kolory różnych roztworów. Nie należy jednak uważać, że jedynie zjawisko absorpcji odpowiada za powstawanie kolorów. Innymi zjawiskami fizycznymi które powodują że dostrzegamy kolory są zjawiska związane z rozczepieniem, dyfrakcją i interferencją fal świetlnych. Dobrym przykładem są barwne skrzydła motyla lub tęcza.
To, co jest badane w spektroskopii absorpcyjnej to pomiar absorbancji. Najczęściej używa się do tego typu badań dwóch konfiguracji spektrometrów – jednowiązkowe oraz dwuwiązkowe. Wszystkie składają się z tych samym elementów: źródła światła, monochromatora, miejsca na próbkę, detektora oraz układu odczytującego. Źródłem światła jest zazwyczaj zespół dwóch lamp: lampa wolframowa, która emituje fale elektromagnetyczne w zakresie widzialnym (340-800 nm) oraz lampa deuterowa która odpowiada za światło w zakresie ultrafioletu (200-350 nm). Dzięki temu uzyskujemy szerokie spektrum światła do badań. Nałożone na siebie z obu lamp światło powoduje powstanie wiązki światłą białego, które dociera do monochromatora. Zadaniem tego elementu jest rozdzielenie wiązki za pomocą siatki dyfrakcyjnej na poszczególne składowe oraz poprzez ustawienie luster i pryzmatów skierować w miejsce gdzie ma znajdować się próbka wiązkę o określonej długości fali. W ten sposób w próbce może zajść absorpcja określonej długości fali co następnie jest rejestrowane na detektorze który zazwyczaj jest fotopowielaczem. Ostatnim etapem pomiaru jest przesłanie sygnału zarejestrowanego na detektorze do układu odczytującego, którym zwykle jest komputer z odpowiednim sterownikiem.
W spektrometrze jednowiązkowym światło przechodzi najpierw przez próbkę odniesienia gdzie zostaje zapisane jej widmo. Takie widmo nazywane jest wtedy widmem odniesienia, tłem lub baseline-em. Próbka odniesienia zawiera zwykle sam rozpuszczalnik (np. roztwory buforowe, woda, etanol) który sam z siebie może absorbować pewne długości fali. Następnie zmieniamy próbkę odniesienia na badaną substancję, czyli do zmierzonego rozpuszczalnika dodajemy to co nas interesuje (np. barwniki takie jak chlorofile, karotenoidy). Analogicznie mierzymy widmo absorpcji, z tą różnicą że od uzyskanego teraz widma odejmujemy wcześniej otrzymane widmo odniesienia. Dzięki temu otrzymujemy widmo samego barwnika, a nie nałożone widmo rozpuszczalnika z barwnikiem, które zwykle są nieczytelne.
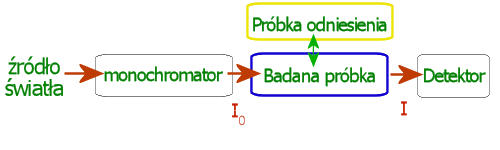
Spektrometr jednowiązkowy
Spektrometr dwuwiązkowy z kolei wymaga przy pomiarze obecności dwóch próbek – jednej do widma odniesienia oraz drugiej z badaną substancją. Jednocześnie przez te próbki przechodzi wiązka światła, które następnie są rejestrowane przez detektora i także odejmowane w celu otrzymania widma interesującej nas substancji bez widma rozpuszczalnika (widmo odniesienia).
Spektrometr dwuwiązkowy
Widmo absorpcji mówi nam, jakie długości fali dana substancja pochłania, co może ją nie tylko zidentyfikować (każda cząsteczka absorbuje światło w inny sposób) lecz także przydaje się w spektrometrii fluorescencyjnej dając informację jaką długością fali wzbudzać próbkę (czyli w miejsce o największej absorpcji). Widmo absorpcji mówi nam, jakie długości fali dana substancja pochłania, co może ją nie tylko zidentyfikować (każda cząsteczka absorbuje światło w inny sposób) lecz także przydaje się w spektrometrii fluorescencyjnej dając informację jaką długością fali wzbudzać próbkę. Próbki jakie bada się w spektrometrach umieszcza się w prostopadłościennych naczyniach nazywanych kuwetami wykonanymi zwykle ze szkła lub plastiku. Jeżeli badania absorpcji dotyczą zakresu ultrafioletowego, trzeba użyć kuwety wykonanej ze szkła kwarcowego, ponieważ zwykłe szkło samo z siebie absorbuje ten zakres fal co uniemożliwia pomiar. Kuwety plastikowe ze względu na swoją nietrwałość używane są do pomiarów jednorazowych. Ważne jest aby używać kuwet o identycznych właściwościach optycznych, gdyż grubsze ścianki lub inny typ szkła spowodują przekłamanie wyników badań. Należy także pamiętać że do spektroskopii absorpcyjnej nie należy badać dużych stężeń, gdyż wiązka światła musi przejść przez całą próbkę, a nie zostać całkowicie zaabsorbowana wewnątrz. Do spektrometru wkłada się rozcieńczone próbki gdzie „na oko” widać że próbka jest przeźroczysta lub delikatnie zabarwiona. Czułość spektrometru w zupełności wystarczy aby zidentyfikować badaną substancje po jej widmie.